
繼上回的準備篇和菌種篇,這回要真正測定了。在各個測定管孵育20小時以上獲得zui大濁度時,即可用渦旋振蕩器混勻,之后倒入1cm比色杯,在540nm處測定吸光度(OD值)。以未接種的對照管的OD值為0,依次測定標準管、樣本。如果對照管OD值>0.1,或者標準管OD值變化<40%,說明有雜菌或葉酸混入,需重做。
測完OD值后,以葉酸含量為橫坐標,每個標準管OD均值為縱坐標,做標準曲線。根據樣本OD值和標準曲線,可以確定樣品對應的葉酸含量。關于標準曲線,有人發現OD值隨著葉酸濃度增加而增長趨緩, 略呈S形。若使用線性方法,數據點分布在曲線兩側,求得的葉酸濃度不準。建議使用EXCEL功能建立4階曲線方程,則曲線與實驗數據的擬合程度較好(1)。
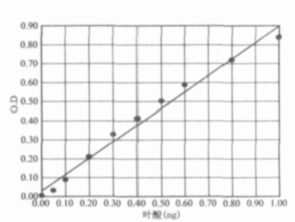
圖1. 1階線性擬合
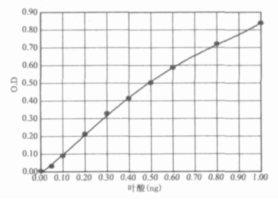
圖2. 4階線性擬合,優于1階
采用直接提取法進行的葉酸含量可按如下公式進行計算。其前提是:每個樣品有2個管葉酸含量在0.10ng-0.80ng范圍內,且各管間偏差小于10%。
計算公式:
葉酸含量(g/100g)= (C*V*f)/m * 0.1
C為樣品稀釋液葉酸濃度(ng/ml),V為提取液定容體積(ml),f為樣本提取液稀釋倍數,m為樣本質量(g),0.1為ng/g換算為g/100g的系數。
以上就是相對完整的測定過程,不僅適合嬰兒配方食品,也適合谷薯、果蔬、豆及堅果類食品,只不過樣品需要用酶解提取法。大致過程如下:準確稱量適量試樣(0.2-2g葉酸),如堅果類是0.2-2g,至0.0001g,轉入100ml錐形瓶中,加30mlPBS(含抗壞血酸作為葉酸保護劑),混勻5分鐘后高壓滅菌。再加1ml雞胰腺溶液。對于蛋白和淀粉含量豐富的樣本,應再加1ml蛋白酶和淀粉酶溶液。再加3至5滴甲苯后,37℃孵育16小時,再轉入100ml容量瓶,加水定容,過濾。
之所以采取酶解法,是因為在一些食品中葉酸以蛋白結合的形式存在,以上提取方法是依據中國預防科學院食品與衛生研究所對食品前提取方法進行的研究(2)。該研究還發現,蔬菜樣品采用二次水解法效果比較好;葉酸在酸性和過堿性環境中破壞嚴重,因此樣品提取液和培養基pH值應控制在6.8-7.2。
世界微生物培養基生產商HiMedia提供全系列進口維生素測定用培養基,其中葉酸干酪培養基(貨號M543),維生素B12測定培養基(貨號M036),質量為標準,成分*符合我國相關國家食品安全標準。常規到貨期4-6周,加急訂單2-3周。詳情可詳詢國內總代理北京締一生物:。
參考文獻
1. 唐靚,等.國標<食品中葉酸的測定>的標準曲線繪制與計算.中國衛生檢驗雜志. 2009,19(7):
2.王竹. 樣品前處理對食物中葉酸測定的影響.衛生研究. 2000, 29 (6):404-406