
俗話說“病從口入”,這種經驗之談究竟有幾分科學道理呢?
人體內環境其實非常復雜,咱們的腸道里寄生著大量微生物,據說菌落重達幾公斤。腸道定居的微生物對維持體內平衡有重要作用。不過,一些時候有潛在致病能力的細菌也會混在其中,誘發腸道炎癥,比如肝螺桿菌(Helicobacter hepaticus)。腸道微生物和宿主的免疫系統間有很多,有時可維護腸道健康,有時則相反,其結果取決于腸道微生物的種類、免疫應答、宿主的遺傳因素和其他環境因素等等。雜志《經濟學人》(The Economist)曾以“Microbes maketh man”為題專門探討過微生物對人類的重要性(下圖)。

對于那些原本就住在腸道里的微生物,我們的免疫系統早已有了應對的措施,某種程度上可以說已經馴服了這些微生物。但如果細菌“外來戶”侵入了腸道,腸道的免疫系統可能就有點犯怵了。科學界已經知道口腔里的細菌如果定居到腸道會引起多種炎性疾病,不過人類的口腔里細菌種類也不少,究竟是哪些口腔細菌會給腸道帶來麻煩呢?zui近,來自日本慶應義塾大學(Keio University)醫學院的 Kenya Honda 和早稻田大學的 Masahira Hattori 等研究者在 Science 雜志發表文章,證明了唾液微生物群落中的克雷伯菌(Klebsiella)移植到腸道中,會誘發慢性腸道炎癥。
克雷伯菌形態示意圖。
為了鑒定出能夠移植腸道并持續導致慢性炎癥的菌株,研究者將兩名克羅恩病(Crohn's disease,又稱局限性腸炎)患者的唾液植入無菌小鼠的腸道中。他們發現移植了唾液的小鼠的排泄物與對照組的小鼠不同,主要是腸道 T 輔助細胞 1(T helper 1,TH1)的量有變化。他們發現,一種肺炎克雷伯菌(Klebsiella pneumoniae)菌株 Kp-2H7 是誘導 TH1 細胞介導的炎性免疫反應的“主犯”。這種克雷伯菌對多種抗生素有抵抗力,包括氨芐青霉素和泰樂菌素。無特定病原體(SPF)的小鼠對 Kp-2H7 的腸道定植具有抗性,不過用氨芐青霉素或泰樂菌素處理后,Kp-2H7 就可以在小鼠腸道中持續存活,同時 TH1 細胞數量也會增長。
盡管來源于口腔的克雷伯菌 Kp-2H7 在野生型小鼠體內不能誘導結腸炎,但會誘導白細胞介素 10(IL-10)缺陷小鼠發生嚴重的結腸炎癥狀。這表明微生物和宿主腸道免疫系統發生相互作用時,是否發生有害的炎癥反應還取決于一些特定的情況,比如抗生素誘導的微生物群落擾動或者宿主的遺傳因素。

野生型小鼠的腸道不受克雷伯菌 Kp-2H7 影響,但 IL-10 缺陷小鼠則會因 Kp-2H7 產生炎癥。
腸道微生物能夠調節宿主先天性免疫和獲得性免疫兩種免疫應答方式,甚至會影響宿主對某種治療方式(如癌癥免疫療法)的響應性。在我們的免疫系統中,不同的病原體會誘導不同類型 T 細胞亞型的極化。有意思的是,遷移到腸道的克雷伯菌 Kp-2H7 不影響抗炎的調節性 T 細胞,反而會誘導腸道炎性 TH1 細胞的產生,這說明其中的機制或許與眾不同。越來越多的證據表明,口腔和腸道微生物生物群對于非腸道炎性疾病,如心血管疾病、自身免疫性腦脊髓炎和關節炎的發作和進展都具有顯著影響,其中的關鍵就是誘導產生可遷移到遠處發炎組織的炎性免疫細胞。
為了研究克雷伯菌 Kp-2H7 誘導的 TH1 細胞介導炎癥反應的機制,研究者使用了幾種缺乏某些先天性免疫應答和獲得性免疫應答的小鼠模型。他們發現,樹突細胞(DC)通過 Toll 樣受體 4(TLR4)信號通路誘導了這種特異性的 TH1 細胞免疫應答。而且,受 TLR4 信號激活的上皮細胞會產生白細胞介素 -18(IL-18),能進一步放大這種 TH1 細胞免疫應答。
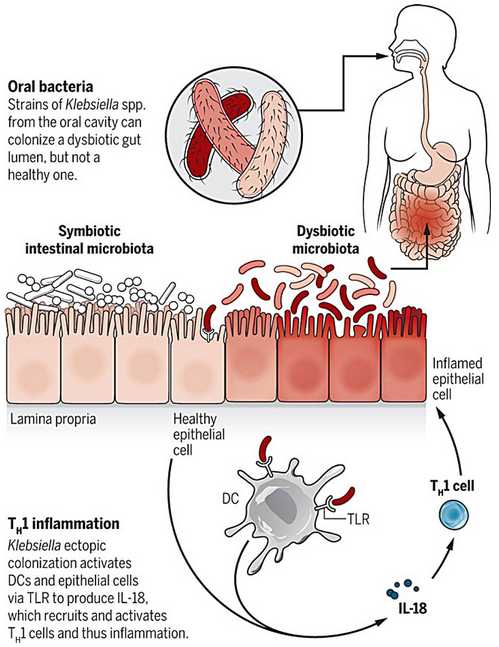
口腔細菌誘發慢性腸炎的機制。
研究者還發現了與 Kp-2H7 十分類似的另一種克雷伯菌(Klebsiella aeromobilis)菌株 Ka-11E12,它來自一位潰瘍性結腸炎患者的唾液樣本,對抗生素有耐藥性,可誘導特異性的 TH1 細胞免疫應答,還可在 IL-10 缺陷小鼠中引發嚴重的腸道炎癥。更驚人的是,一種來自健康人唾液樣品的肺炎克雷伯菌(Klebsiella pneumoniae)菌株 Kp-40B3,也可以在腸道中誘導類似的 TH1 細胞免疫應答。這說明其他克雷伯菌菌株或者克雷伯菌以外的其他細菌,都可能是類似的潛在炎性腸道疾病的病原體。(趕快去立項啊……)
這一結果在臨床上意義重大,這是科學家*次如此清晰而有力地證明來自口腔的細菌能直接導致腸道疾病,并且也可能參與其他很多疾病的病理過程。“病從口入”不再只是一句經驗之談,而是有了堅實的科學證據。
同期 Science 上還刊登了中國醫學科學院曹雪濤院士對這一工作的評論文章“Intestinal inflammation induced by oral bacteria”(Science, 2017, 358, 308-309)。
此外,這一研究也再次證明了微生物群落對人類的重要性。哪些微生物是人體的“友好居民”?哪些是“不法分子”?人體的免疫系統如何識別?這些問題都有待更多的研究去探討。但毫無疑問的是,微生物群落對維持人體腸道穩態和身體健康起到了關鍵作用,這對藥物研發和用藥安全都是重要的啟示。