
PCR污染是每個實驗室都多多少少會遇到的問題。原因在于,PCR是非常靈敏的一項檢測,100個拷貝之內的靶序列就足以產生陽性擴增,從而容易出現DNA污染導致的假陽性。那么,怎樣遠離PCR的污染呢?
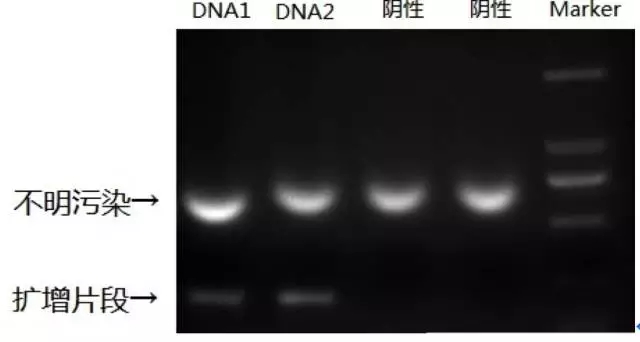
圖 PCR污染之一瞥
首先,要辨別PCR污染的來源。設立陰陽性對照,有利于檢測反應體系各成分的污染情況。尤其是設立空白對照,即包括PCR的全部組分,而不加模板DNA,這對檢測試劑中PCR產物殘留污染是非常有益的。
在排除試劑污染的可能性外,更換試劑后,若不久又發現試劑被污染了,則考慮可能為環境污染。環境污染的zui主要原因是DNA溶液的濺出和DNA氣溶膠造成的實驗區域的污染,這尤其在PCR產物擴增區容易出現。移液器槍頭和EP管架是也較常見的污染部位。
如果是環境污染,還可對每個區域進行涂抹采樣和核酸提取,以zui終鑒定污染的區域所在。德國Minerva Biolabs公司專門生產有DNA污染監測試劑盒(貨號181-0010和182-0010),比較方便使用。

對PCR的環境污染,有如下幾種治理方法:
1. 用常規消毒液定期在環境中噴霧消毒處理。
2. 稀酸處理法:對可疑器具用1mol/L鹽酸擦拭或浸泡,使殘余DNA脫嘌呤;其缺點是鹽酸對皮膚有一定的腐蝕性。
3. 紫外照射法:紫外波長一般選擇254/300nm,照射30分鐘至2小時。但需要注意的是,UV照射僅對500bp以上長片段有效,對短片段效果不大。
4. 選用商品化的DNA污染祛除劑。我們推薦的是Minerva公司的PCR CleanTM 噴霧劑、濕巾。其1分鐘即起效,方便快捷,*,可同時去除DNA和RNA。作用1分鐘后,用紙巾擦拭,即可完成對DNA污染的清除。

對于PCR反應液的污染,可采取以下方法:
1. DNase I 法:PCR混合液(未加模板和Taq聚合酶)加入0.5U DNase I,室溫反應30min后加熱滅活,然后加入模板和Taq聚合酶進行正常PCR擴增。
2. 內切酶法:選擇識別4個堿基的內切酶(如MspI和TaqI等),可同時選擇幾種,以克服用一種酶只能識別特定序列的缺陷,室溫作用1h后加熱滅活進行PCR。
3. 紫外照射法:未加模板和Taq聚合酶的PCR混合液進行紫外照射,注意事項與方法同上述UV照射法。
4. 尿嘧啶糖苷酶(UNG)法:用dUTP代替dTTP,使PCR產物中摻入大量dU。在再次進行PCR擴增前,用UNG處理PCR混合液即可消除PCR產物的殘留污染。由于UNG在PCR循環中的變性一步便可被滅活,因此不會影響含dU的新的PCR產物。
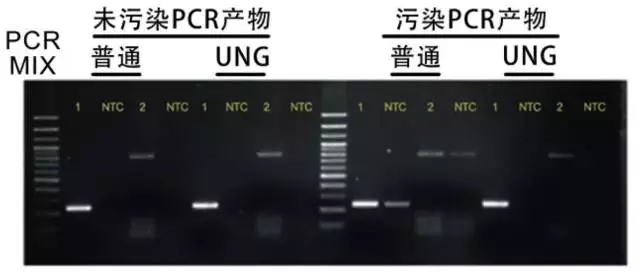
圖 UNG法預防污染
總之,靈敏度越高的PCR反應越容易出現PCR污染。采用適當的措施消除污染,可以避免重復實驗和浪費試劑,也使得實驗結果更加可靠而。
參考資料
唐艷榮,張海云,等。聚合酶鏈式反應(PCR)中主要污染源及處理方法的分析。農業開發與裝備,2017(3):99-100
周榮榮,李超。日照市疾病預防控制中心PCR實驗室污染情況調查。 醫學檢驗與臨床, 2017,28(5):61-63